Az IPTG (izopropil-β-D-tiogalaktozid) a β-galaktozidáz szubsztrát analógja, amely erősen indukálható.Az IPTG indukciója során az induktor komplexet képezhet a represszor fehérjével, így a represszor fehérje konformációja megváltozik, így az nem kombinálható a célgénnel, és a célgén hatékonyan expresszálódik.Tehát hogyan kell meghatározni az IPTG koncentrációját a kísérlet során?Minél nagyobb, annál jobb?
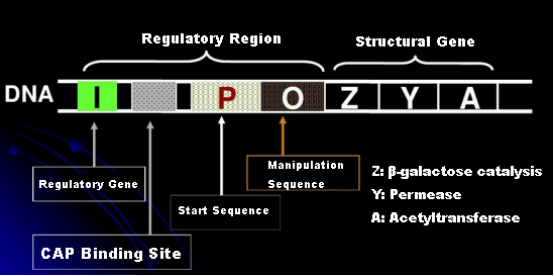
Először is értsük meg az IPTG indukció elvét: az E. coli laktóz operonja (eleme) három szerkezeti gént tartalmaz, a Z, Y és A gént, amelyek β-galaktozidázt, permeázt és acetiltranszferázt kódolnak.a lacZ a laktózt glükózzá és galaktózzá, vagy allo-laktózzá hidrolizálja;a lacY lehetővé teszi a környezetben lévő laktóz átjutását a sejtmembránon, és bejut a sejtbe;A lacA átviszi az acetilcsoportot az acetil-CoA-ról a β-galaktozidra, ami a mérgező hatás eltávolításával jár.Ezen kívül van egy O működési szekvencia, egy P kiindulási szekvencia és egy szabályozó gén I. Az I génkód egy represszor fehérje, amely képes kötődni az operátor szekvencia O pozíciójához, így az operon (meta) elnyomódik, ill. kikapcsolt.Van egy kötőhely is a katabolikus génaktivátor fehérje-CAP kötőhely számára a P iniciációs szekvenciától 5'-irányban. A P szekvencia, az O szekvencia és a CAP kötőhely együtt alkotják a lac operon szabályozó régióját.A három enzim kódoló génjeit ugyanaz a szabályozó régió szabályozza a géntermékek összehangolt expressziójának elérése érdekében.
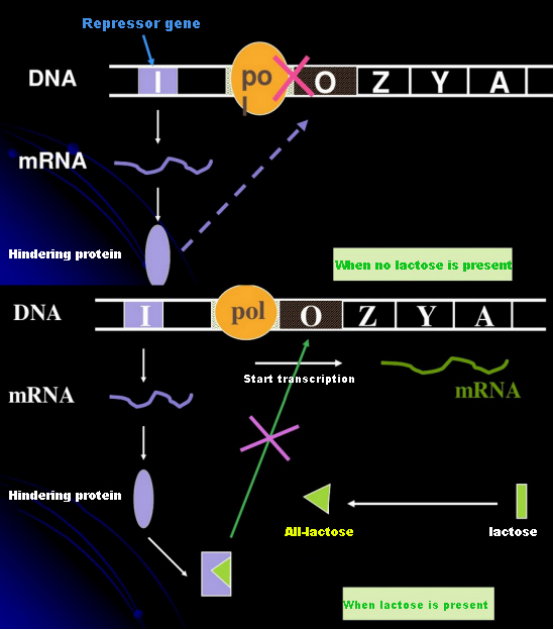
Laktóz hiányában a lac operon (meta) elnyomott állapotban van.Ekkor a PI-promoterszekvencia szabályozása alatt álló I-szekvencia által expresszált lac-represszor az O-szekvenciához kötődik, ami megakadályozza, hogy az RNS-polimeráz kötődjön a P-szekvenciához, és gátolja a transzkripció beindulását;laktóz jelenléte esetén a lac operon (meta) indukálható Ebben az operon (meta) rendszerben az igazi induktor nem maga a laktóz.A laktóz belép a sejtbe, és a β-galaktozidáz katalizálja, hogy allolaktózzá alakuljon.Ez utóbbi induktor molekulaként a represszor fehérjéhez kötődve megváltoztatja a fehérje konformációját, ami a represszor fehérje O szekvenciától való disszociációjához és transzkripciójához vezet.Az izopropil-tiogalaktozidnak (IPTG) ugyanaz a hatása, mint az allolaktóznak.Nagyon erős induktor, amelyet a baktériumok nem metabolizálnak, és nagyon stabil, ezért széles körben használják laboratóriumokban.
Hogyan határozható meg az IPTG optimális koncentrációja?Vegyük például az E. colit.
A pozitív rekombináns pGEX-et (CGRP/msCT) tartalmazó, genetikailag módosított E. coli BL21 törzset 50 µg·mL-1 Amp-t tartalmazó LB folyékony táptalajba oltottuk, és egy éjszakán át 37 °C-on tenyésztettük.A fenti tenyészetet 10 üveg 50 ml-es friss LB folyékony tápközegbe oltottuk be, amely 50 µg·mL-1 Amp-t tartalmazott 1:100 arányban expanziós tenyészethez, és amikor az OD600 érték 0,6-0,8 volt, IPTG-t adtunk a végső koncentrációhoz.Ez 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0 mmol·L-1.Azonos hőmérsékleten és ugyanabban az időben történő indukciót követően 1 ml baktériumoldatot vettünk ki belőle, majd a baktériumsejteket centrifugálással összegyűjtöttük és SDS-PAGE-nek vetették alá, hogy megvizsgáljuk a különböző IPTG koncentrációk hatását a fehérje expresszióra. válassza ki a legnagyobb fehérje expressziójú IPTG koncentrációt.
A kísérletek után kiderül, hogy az IPTG koncentrációja nem olyan nagy, amennyire csak lehetséges.Ennek az az oka, hogy az IPTG bizonyos toxicitást mutat a baktériumokra.A koncentráció túllépése a sejtet is megöli;és általánosságban elmondható, hogy reméljük, minél több oldható fehérje expresszálódik a sejtben, annál jobb, de sok esetben, ha az IPTG koncentrációja túl magas, nagy mennyiségű zárvány képződik.Test, de az oldható fehérje mennyisége csökkent.Ezért a legmegfelelőbb IPTG koncentráció gyakran nem a nagyobb, annál jobb, hanem annál alacsonyabb a koncentráció.
A genetikailag módosított törzsek indukciójának és tenyésztésének célja a célfehérje hozamának növelése és a költségek csökkentése.A célgén expresszióját nemcsak a törzs saját faktorai és az expressziós plazmid befolyásolják, hanem egyéb külső körülmények is, mint például az induktor koncentrációja, az indukciós hőmérséklet és az indukciós idő.Ezért általában, mielőtt egy ismeretlen fehérjét expresszálnak és tisztítanak, a legjobb az indukciós idő, a hőmérséklet és az IPTG koncentráció tanulmányozása a megfelelő körülmények kiválasztása és a legjobb kísérleti eredmények elérése érdekében.
Feladás időpontja: 2021. december 31

