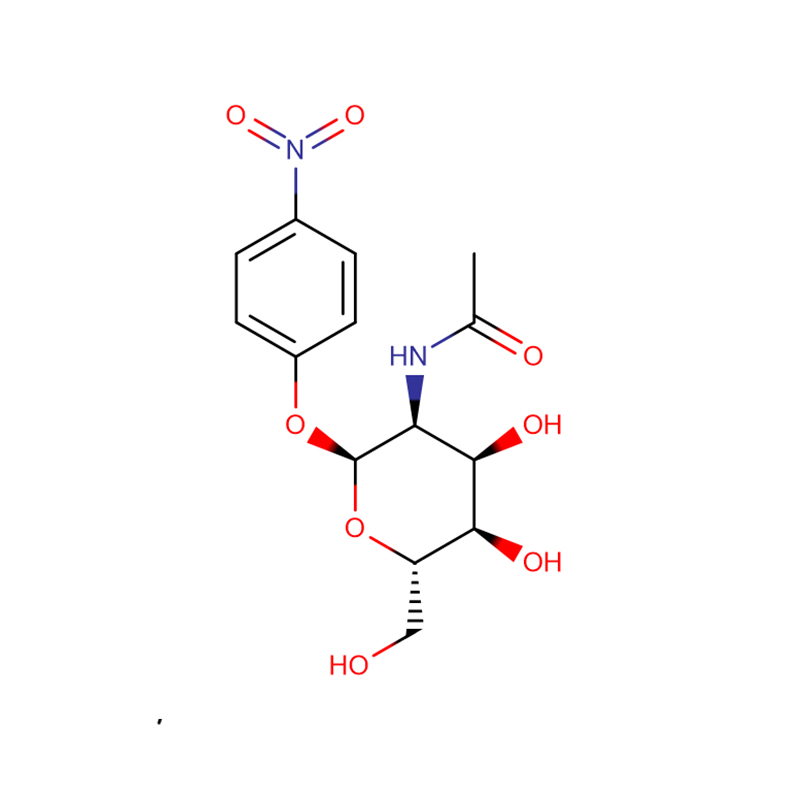
p-nitrofenil-aL-fukopiranozid Cas:10231-84-2 Fehértől halványsárgáig terjedő kristályos por
| Katalógus szám | XD90142 |
| termék név | p-nitrofenil-al-fukopiranozid |
| CAS | 10231-84-2 |
| Molekuláris képlet | C12H15NO7 |
| Molekuláris tömeg | 285,25 |
| Tárolási részletek | 2-8 °C |
| Harmonizált Vámkódex | 29400000 |
Termékleírás
| Kinézet | Fehér vagy halványsárga kristályos por |
| Assay | 99% |
| TLC | Egyetlen helyszín |
| Tisztaság HPLC | min 98% |
| Oldhatóság (1 % vízben) | Tiszta színtelen oldat |
| Sűrűség | 1,503±0,06 g/cm3 (20 °C, 760 Torr), |
| Olvadáspont | 196-197 °C |
| Forráspont | 515,4°Cat760 Hgmm |
| Lobbanáspont | 265,5 °C |
| Törésmutató | 1.623 |
A LecA (PA-IL) a Pseudomonas aeruginosa által termelt citotoxikus lektin és adhezin, amely nagy specifitással és affinitással köti meg a hidrofób galaktozidokat.A lecA-egfp transzlációs fúzió és a biofilm extracelluláris mátrix immunoblot analízisével megmutatjuk, hogy a lecA biofilmben növesztett sejtekben expresszálódik.Mind a polisztirol, mind a rozsdamentes acél statikus biofilm tesztjei során a biofilm mélységét és felületi lefedettségét csökkentette a lecA mutációja, és fokozta a LecA-t túltermelő PAO-P47 törzs.A PAO-P47 szülőtörzs, de nem az acél szelvényeken lévő lecA mutáns biofilm felületi lefedettségét is gátolta az izopropil-béta-D-tiogalaktozid (IPTG) vagy a p-nitro-fenil-alfa-D-galaktozid jelenlétében történő növekedés. NPG).Ezen túlmenően, ezen hidrofób galaktozidok hiányában képződött érett vad típusú biofilmek IPTG hozzáadásával diszpergálhatók.Ezzel szemben a P. aeruginosa LecB (PA-IIL) lektinek iránt nagy affinitással rendelkező p-nitrofenil-alfa-L-fukóz (NPF) hozzáadása nem volt hatással a biofilm képződésére vagy szétszóródására.A P. aeruginosa PAO1 plankton növekedését nem befolyásolta az IPTG, NPG vagy NPF jelenléte, és a törzs sem tudta ezeket a cukrokat szénforrásként hasznosítani, ami arra utal, hogy a biofilm képződésre gyakorolt megfigyelt hatások a LecA-ligand kompetitív gátlásának tudhatók be. kötés.Hasonló eredményeket kaptak a dinamikus áramlási körülmények között acélszelvényeken termesztett biofilmek esetében is, ami arra utal, hogy a LecA hozzájárul a P. aeruginosa biofilm építészetéhez különböző környezeti feltételek mellett.
Az Arabidopsis növények leveleiben kimutattak egy alfa-L-fukozidázt (EC 3.2.1.51), amely képes felszabadítani a xiloglukán oligoszacharidok oldalláncából a t-fukozil-maradékot.Ezenkívül egy hasonló szubsztrát-specifitású alfa-L-fukozidázt tisztítottunk káposzta (Brassica oleracea) leveleiből, hogy egyetlen sávot képezzenek az SDS-PAGE-n.Ebből a fehérjesávból két peptidszekvenciát kaptunk, és ezeket használták egy alfa-fukozidázt kódoló Arabidopsis gén azonosítására, amelyet AtFXG1-nek javasolunk.Emellett egy ismert alfa-L-fukozidázokkal homológiát mutató Arabidopsis gént is találtak, és azt javasoltuk, hogy nevezzük el AtFUC1-nek.Mind az AtFXG1, mind az ATFUC1 heterológ módon expresszálódott Pichia pastoris sejtekben, és az alfa-L-fukozidáz aktivitások szekretálódtak a táptalajba.Az AtFXG1 által kódolt alfa-L-fukozidáz a xiloglukán XXFG-ből származó oligoszacharidok, valamint a 2'-fukozil-laktit ellen volt aktív, a p-nitro-fenil-alfa-L-fukopiranozid ellen azonban nem.A heterológ módon expresszált AtFUC1 azonban csak a 2'-fukozil-laktit ellen volt hatásos.Így az előbbinek a xiloglukán anyagcserével kell kapcsolatban lennie.