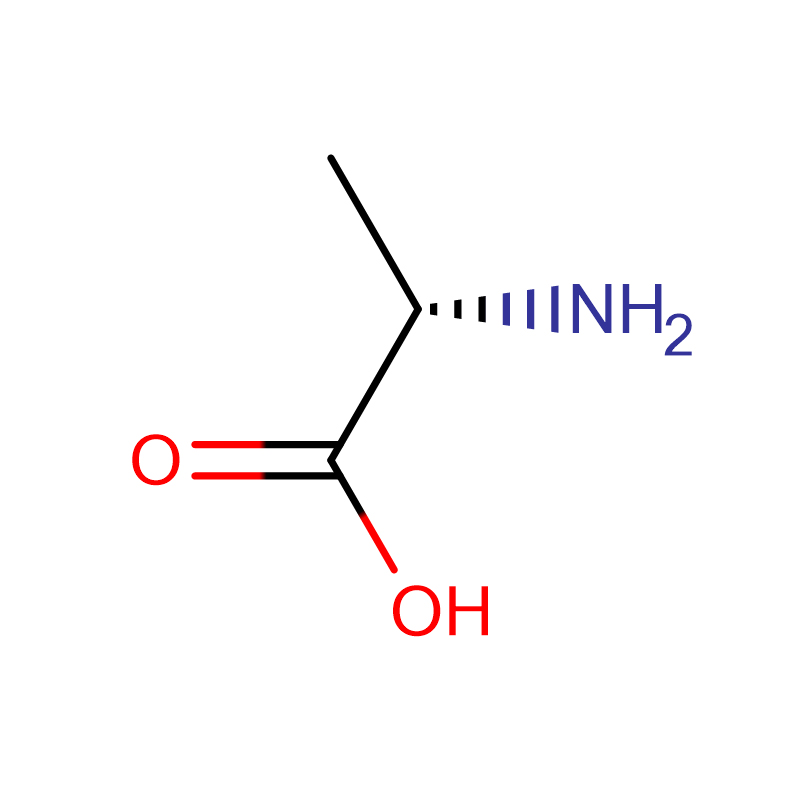
L-alanin CAS:56-41-7 99% Fehér kristályos por
| Katalógus szám | XD90326 |
| termék név | D-alanin |
| CAS | 338-69-2 |
| Molekuláris képlet | C3H7NO2 |
| Molekuláris tömeg | 89.09 |
| Tárolási részletek | Környező |
| Harmonizált Vámkódex | 29224985 |
Termékleírás
| Kinézet | Fehér kristályos por |
| Próba | 98,5–101,5% |
| Fajlagos forgás | +13,7-től +15,1-ig |
| Nehéz fémek | <0,0015% |
| pH | 5,5-7 |
| SO4 | <0,03% |
| Szárítási veszteség | <0,2% |
| Vas | <0,003% |
| Maradék gyújtáson | <0,15% |
| Részecske méret | 200um |
| Cl | <0,05% |
| A perzisztens szerves szennyező anyagok szintje | Nincsenek szennyező anyagok |
A γ-glutamil-transzpeptidázok (γ-GT-k) elhasítják a glutation γ-glutamil-amid kötését, és a felszabaduló γ-glutamil-csoportot vízbe (hidrolízis) vagy akceptor aminosavakba (transzpeptidáció) viszik át.Ezek a mindenütt jelenlévő enzimek kulcsszerepet játszanak a glutation bioszintézisében és lebontásában, valamint a xenobiotikus méregtelenítésben.Itt közöljük a Bacillus licheniformis γ-GT (BlGT) és l-Glu-val alkotott komplexének 3Å felbontású kristályszerkezetét.A röntgensugaras szerkezetek megerősítik, hogy a BlGT az N-terminális nukleofil hidroláz szupercsaládhoz tartozik, és azt mutatják, hogy a fehérje nyitott aktív hely hasítással rendelkezik, amely hasonló a Bacillus subtilis homológ enziménél leírtakhoz, de különbözik a humán γ-GT és más mikroorganizmusokból származó γ-GT-k esetében.Az adatok azt sugallják, hogy az l-Glu kötődése a BlGT nagy alegység C-terminális farkának átrendeződését idézi elő, és lehetővé teszi a savmaradékok olyan klaszterének azonosítását, amelyek potenciálisan részt vesznek egy fémion felismerésében.Ezeknek a maradékoknak a BlGT konformációs stabilitásában betöltött szerepét négy új Ala egyedi mutáns autoprocessziójának, enzimatikus aktivitásának, kémiai és termikus denaturációjának jellemzésével tanulmányozták.Az eredmények azt mutatják, hogy az Asp568 helyettesítése Ala-val befolyásolja a fehérje automatikus feldolgozását és szerkezeti stabilitását.